ASAM DAN BASA
DAFTAR ISI
ASAM DAN BASA
- Untuk menyelesaikan tugas kimia yg diberi oleh bapak Darwison,M.t
- Untuk memahami materi tentang asam basa.
- Untuk menambah wawasan terkait materi asam basa.
- Alat
- Bahan
Definisi Brønsted tentang asam dan basa adalah konsep dari pasangan asam-basa konjugasi. Asam bronsted adalah spesies yang tersisa ketika satu proton telah dikeluarkan dari asam (sebagai zat yang mampu menyumbangkan proton). Sebaliknya, basa bronsted adalah spesies yang dimasukkan atau mendapatkan proton (sebagai zat yang dapat menerima proton).
Setiap asam Brønsted memiliki basa konjugasi, dan setiap basa Brønsted memiliki asam konjugasinya. Misalnya, ion klorida (Cl2) adalah basa konjugasi yang terbentuk dari asam HCl, dan H3O1 (ion hidronium) adalah asam konjugasi dasar H2O.
Demikian pula, ionisasi asam asetat yang menunjukkan dua pasangan asam-basa konjugasi. Jadi, asetat
ion (CH3COO) adalah basa konjugasi dari asam CH3COOH. Sedangkan H3O adalah asam konjugasi dari H2O.
Definisi Brønsted juga memungkinkan kita untuk mengklasifikasikan amonia sebagai basa karena
dari kemampuannya menerima proton:
Dalam hal ini, NH14 adalah asam konjugasi dari basa NH3, dan ion hidroksida OH2 adalah basa konjugasi dari asam H2O. Perhatikan bahwa atom dalam basis Brønsted itu menerima ion H1 harus berpasangan mandiri.
Salah satu sifat khususnya adalah kemampuannya untuk bertindak sebagai asam atau basa. Air berfungsi sebagai basa dalam reaksi dengan asam seperti HCl dan CH3COOH, dan berfungsi sebagai asam dalam reaksi dengan basa seperti NH3. Air adalah elektrolit yang sangat lemah dan karenanya merupakan penghantar listrik yang buruk, tetapi ia mengalami ionisasi sampai batas kecil:
Produk Ion Air
Karena kita menggunakan H+ (aq) dan H3O+ (aq) secara bergantian untuk merepresentasikan proton terhidrasi,
konstanta kesetimbangan juga dapat dinyatakan sebagai
Kc = [H+] [OH-]
Untuk menunjukkan bahwa konstanta kesetimbangan mengacu pada ionisasi air, maka nilai Kc dapat diganti dengan Kw
Kw= [H3O+] [OH-]= [H+] [OH-]
di mana Kw disebut konstanta produk-ion, yang merupakan hasil kali dari konsentrasi molar
ion H+ dan OH- pada suhu tertentu.
Contoh soal :Konsentrasi ion OH2 dalam larutan pembersih amonia rumah tangga tertentu adalah
0,0025 M. Hitung konsentrasi ion H1.
Jawab :
Karena konsentrasi ion H+ dan OH- dalam larutan air sering kali jumlahnya sangat kecil dan karenanya tidak nyaman untuk digunakan, Soren Sorensen † pada tahun 1909 mengusulkan pengukuran yang lebih praktis yang disebut pH. PH larutan didefinisikan sebagai logaritma negatif konsentrasi ion hidrogen (dalam mol / L):
Karena pH hanyalah cara untuk menyatakan konsentrasi ion hidrogen, asam dan larutan dasar pada suhu 25 ° C dapat dibedakan dari nilai pH-nya, sebagai berikut:
Gambar 15.2 Pengukur pH (pH meter)
pH meter adalah alat yang biasa digunakan di laboratorium untuk menentukan pH suatu larutan. Meski banyak pH meter punya skala yang ditandai dengan nilai dari 1 sampai 14, nilai pH sebenarnya bisa kurang dari 1 dan lebih besar dari 14.
Skala pOH yang dianalogikan dengan skala pH dapat dibuat menggunakan logaritma negatif
Contoh :
1) Konsentrasi ion H+ dalam botol anggur meja adalah 3,2 x 10(-4) M tepat setelah
gabus telah dilepas. Hanya setengah dari anggur yang dikonsumsi. Separuh lainnya, setelah itu
berdiri terbuka di udara selama sebulan, ditemukan memiliki konsentrasi ion hidrogen
sama dengan 1,0 x 10(-3) M. Hitung pH anggur pada dua kesempatan ini.
Jawab :
2) Suatu larutan NaOH [OH-] memiliki konsentrasi sebesar 2,9 x 10(-4 ) M. Hitung pH larutan tersebut.
Jawab :
Asam kuat adalah elektrolit kuat yang diasumsikan terionisasi sepenuhnya dalam air . Sebagian besar asam kuat adalah asam anorganik: asam klorida (HCl), asam nitrat (HNO3), asam perklorat (HClO4), dan asam sulfat (H2SO4):
Figure 15.3 Luasnya ionisasi asam kuat seperti HCl (kiri) dan sejenis asam lemah
sebagai HF (kanan). Awalnya ada Ada 6 molekul HCl dan 6 HF.
Asam kuat diasumsikan terionisasi sepenuhnya dalam larutan.
Proton ada dalam larutan sebagai ion hidronium (H3O1).
Pada kesetimbangan, larutan asam kuat tidak akan mengandung asam nonionisasi molekul. Kebanyakan asam adalah asam lemah, yang hanya terionisasi dalam batas tertentu dalam air. Di kesetimbangan, larutan asam lemah mengandung campuran asam tak terionisasi molekul. Contoh asam lemah adalah hidrofluorik asam (HF), asam asetat (CH3COOH), dan ion amonium (NH4 1).
Seperti asam kuat, basa kuat adalah elektrolit kuat yang terionisasi sepenuhnya air. Hidroksida logam alkali dan logam alkali tanah tertentu merupakan basa kuat. Semua hidroksida logam alkali dapat larut. Dari hidroksida alkali tanah, Be (OH)2 dan Mg (OH)2 tidak larut; Ca (OH)2 dan Sr (OH)2 sedikit larut; dan Ba (OH)2 dapat larut. Beberapa contoh basa kuat adalah
Jadi, ketika kita menyebut NaOH atau logam hidroksida lainnya sebagai basa, sebenarnya yang kita maksud adalah ke spesies OH2 yang diturunkan dari hidroksida.
Basa lemah adalah elektrolit lemah. Amonia adalah basa lemah. Itu terionisasi sampai batas yang sangat terbatas dalam air:
Perhatikan bahwa, tidak seperti asam, NH3 tidak menyumbangkan proton ke air. Sebaliknya, NH3 berperilaku sebagai basa dengan menerima proton dari air membentuk ion NH4+ dan OH-.
Pasangan asam-basa konjugat memiliki sifat-sifat sebagai berikut:
Jika asam kuat, basa konjugatnya tidak memiliki kekuatan yang dapat diukur. Jadi,
- Ion Cl2, yang merupakan basa konjugasi dari asam kuat HCl, adalah sangat luar biasa dasar lemah.
- H3O+ adalah asam terkuat yang bisa ada dalam larutan air. Asam lebih kuat dari H3O+ bereaksi dengan air menghasilkan H3O+ dan basa konjugsitnya. Jadi, HCl, yang merupakan asam lebih kuat dari H3O+, bereaksi dengan air secara sempurna untuk membentuk H3O+ dan Cl2:Asam yang lebih lemah dari H3O+ bereaksi dengan air dalam jumlah yang jauh lebih kecil, menghasilkan H3O+ dan basa konjugatnya. Misalnya, kesetimbangan berikut terletak terutama ke kiri:
- Ion OH- adalah basa terkuat yang ada dalam larutan air. Basa yang lebih kuat dari OH- bereaksi dengan air menghasilkan OH- dan asam konjugatnya. Misalnya, ion oksida (O-) adalah basa yang lebih kuat daripada OH-, sehingga bereaksi dengan
Sebagian besar asam adalah asam lemah. Ionisasi asam lemah dalam air diwakili oleh HA. Sebagai barikut : Persamaan kesetimbangan untuk ionisasi ini adalah
dengan Ka, adalah konstanta kesetimbangan untuk ionisasi dari asam. Semakin besar Ka, semakin kuat keasamannya yaitu, semakin besar konsentrasi ion H+ pada kesetimbangannyaa. Namun, hanya asam lemah yang memiliki nilai Ka yang terkait dengannya.
Tabel 15.3 mencantumkan sejumlah asam lemah dan nilai Ka pada 25 ° C dalam urutan menurunkan kekuatan asam.
Langkah-langkah utama untuk menyelesaikan masalah ionisasi asam lemah adalah:
1. Identifikasi spesies utama yang dapat mempengaruhi pH larutan. Umumnya kita bisa mengabaikan ionisasi air. Biasanya konsentrasi ion hidroksida ditentukan oleh ion H+.
2. Nyatakan konsentrasi kesetimbangan spesies ini dalam istilah awal konsentrasi asam dan satu x yang tidak diketahui, yang mewakili perubahan dalam konsentrasi.
3. Tuliskan ionisasi asam lemah dan nyatakan konstanta ionisasi Ka dalam suku-suku dari konsentrasi kesetimbangan H+, basa konjugasi, dan serikat pekerja asam. Pertama-tama, selesaikan untuk x dengan metode perkiraan. Jika metode perkiraannya adalah tidak valid, gunakan persamaan kuadrat untuk mencari nilai x.
4. Setelah menyelesaikan x, hitung konsentrasi kesetimbangan dari semua spesies dan / atau pH larutan.
Contoh
Hitung pH larutan asam nitrat (HNO2) 0,036 M:
Solusi
Langkah 1: Spesies yang dapat mempengaruhi pH larutan adalah HNO2, H+, dan
basa konjugasi NO2-. .
Langkah 2 dan 3: Misalkan x adalah konsentrasi kesetimbangan ion H+ dan NO2- dalam mol / L, selanjutnya ringkas dan tulis nilai Ka nya:
Karena ini lebih besar dari 5 persen, maka perkiraan ini tidak valid dan harus menyelesaikan persamaan kuadrat, sebagai berikut:
Persen Ionisasi
Kita telah melihat bahwa besaran Ka menunjukkan kekuatan asam. Ukuran kekuatan asam adalah persen ionisasinya, yang didefinisikan sebagai :
Ketergantungan ionisasi persen pada konsentrasi awal dapat diilustrasikan oleh kasus HF yang dibahas di halaman 680: (Dimana konsentrasi awalnya adalah 0.50 M dan 0.050 M)
Figure 15.4
Ketergantungan persen ionisasi pada awal konsentrasi asam.
Pada konsentrasi yang sangat rendah, semua asam (lemah dan kuat) adalah hampir sepenuhnya terionisasi.
Ionisasi basa lemah diperlakukan dengan cara yang sama seperti ionisasi asam lemah. Ketika amonia larut dalam air, ia mengalami reaksi






































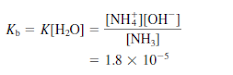







Tidak ada komentar:
Posting Komentar