KUIS 3
1. (Chapter 1)
2. (Chapter 2)
Pembahasan :
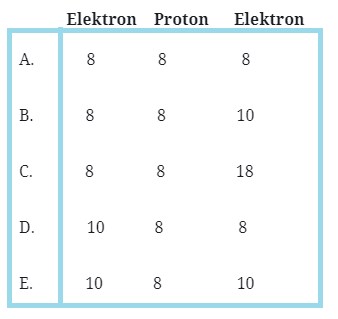
# Z-2 artinya atom Z telah menangkap 2 buah elektronnya sehingga membentuk ion negatif.# Z
- Nomor arom = 8 = jumlah proton = jumlah electron
- Jumlah neutron = nomor massa – jumlah proton = 18 – 8 = 10
- Jumlah electron Z-2= 8 + 2 = 10
- Jumlah proton = 8
- Jumlah neutron = 10
3. (Chapter 3)
4. (Chapter 5)
C. 1/2 P1
D. 1/4 P1
E. 1/8 P1
Jawaban : A
Pembahasan:
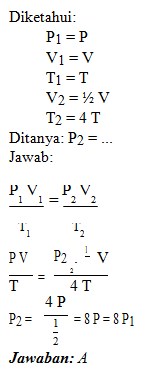
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Jawaban : B
Pembahasan:

5. (Chapter 6)
Jawaban : D
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
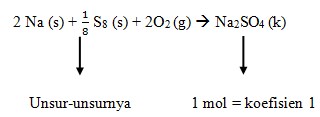
A. 577,6 kJ
B. 578,6 kJ
C. 579,6 kJ
D. 5796 kJ
E. 57,96 kJ
Jawaban: C
Pembahasan:
ΔT = 3°C
= 3 + 273 K = 276 K
Q = m.c. ΔT
= 500 gram x 4,2 J/gram K x 276 K
= 579.600 J = 579, 6 kJ
6. (Chapter 7 )
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
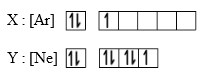
Nomor atom dari unsur X adalah…
A. 17
B. 18
C. 21
D. 26
E. 30
Jawaban : C
Pembahasan :
menentukan nomor atom
Ar dan Ne merupakan golongan gas mulia (VIIIA). Akan sangat membantu jika kita sudah hafal nomor atom dan nomor massa golongan gas mulia karena terkadang dalam soal tidak disebutkan nomor atomnya karena dianggap sudah harus mengerti.
Nomor atom Ar = 18
Nomor atom X = Ar + 3 = 18 + 3 = 21
7. (Chapter 8)
- (1) Massa atom unsur B lebih kecil daripada unsur C.
- (2) Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B.
- (3) Energi ionisasi unsur E lebih kecil daripada unsur D.
- (4) Jumlah elektron valensi unsur A lebih kecil daripada unsur B.
Urutan letak unsur dalam tabel periodik unsur dari kiri ke kanan adalah …
A. A, B, C, D, dan E
B. A, B, C, E, dan D
C. C, E, D, A, dan B
D. E, D, C, B, dan A
E. E, D, A, B, dan C
Jawaban : E
Pembahasan:
- Massa atom unsur B lebih kecil daripada unsur C. Itu artinya, unsur B terletak di sebelah kiri unsur C.
- Keelektronegatifan unsur A lebih besar daripada unsur D tetapi lebih kecil daripada unsur B. Itu artinya, unsur A terletak di sebelah kanan unsur D dan di sebelah kiri unsur B.
- Energi ionisasi unsur E lebih kecil daripada unsur D. Itu artinya, unsur E terletak di sebelah kiri unsur D.
- Jumlah elektron valensi unsur A lebih kecil daripada unsur B. Itu artinya, unsur A terletak disebelah kiri unsur B.
Sehingga, urutan letak unsur dalam tabel periodik unsur dari kiri ke kanan adalah E, D, A, B, dan C.
Jika unsur X,Y,Z adalah unsur-unsur periode ketiga. Pertanyaaan yang benar tentang sifat unsur tersebut adalah ….
A. Jari-jari atom unsur X>Y>Z
B. Kelektronegatifan unsur X>Y>Z
C. Ketiga unsur tersebut memiliki jumlah elektron valensi yang sama.
D. Y dan Z dapat membentuk senyawa dengan rumus Y3Z
Jawaban : A
Pembahasan :
- Unsur X adalah logam sedangkan Y dan Z nonlogam
- Makin besar nomer atom keelektronegatifan unsur semakin besar
- X mempunyai satu elektron velensi
- Y mempunyai lima elektron valensi
- Z mempunyai tujuh lektron valensi
- Senyawa Y dan Z adalah YZ3 atau YZ5
- Dalam satu periode semakin besar nomer atom jar-jari makin kecil, jumlah proton dalam inti semakin banyak sehingga gaya tarik inti semakin kuat
8. (Chapter 9)
A. N2 (nomor atom N = 7)
B. O2 (nomor atom O = 8)
C. H2 (nomor atom H = 1)
D. H2O
Jawaban : B
Pembahasan:
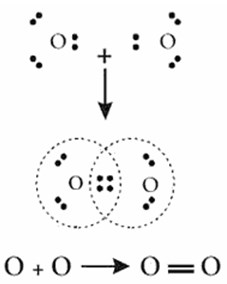
Ikatan rangkap dua terjadi apabila dua pasang elektron berikatan.
8O = 1s2 2s2 2p4 (elektron valensi 6)
A. NH3, N2, O2
B. H2O, HCl, HF
C. PCl3, PCl5, ClO3
D. H2, Br2, CH4
E. HBr, HCl, HI
Jawaban : D
Pembahasan :
Suatu senyawa kovalen dikatakan bersifat non polar apabila yang berikatan adalah 2 atom yang sejenis. Sehingga jawaban yang tepat adalah D.
9. (Chapter 10)
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Tetrahedral terdistorsi
E. Linear
Jawaban : C
Pembahasan :
S = 2 8 6
F = 2 7
SF4 memiliki :
PEI = 4
PEB = 1
Jadi type molekulnya AX4E1 (Tetrahedral)
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Segitiga piramida
E. Segitiga bipiramida
Jawaban : D
Pembahasan :
Konfigurasi elektron kulit utama
₇N = 2 . 5
₁H = 2
Atom N membutuhkan 3 elektron untuk mencapai kestabilan oktet.
Atom H membutuhkan 1 elektron untuk mencapai kestabilan duplet.
Pada senyawa amonia atau NH₃, atom N bertindak sebagai atom pusat yang berikatan dengan 3 buah atom H. Sebagai sesama non logam dan menggunakan elektron bersama, jenis ikatan yang terjadi adalah ikatan kovalen.
Setelah atom pusat N mencapai oktet, masih ada sepasang elektron bebas milik N. Perhatikan mekanisme selanjutnya.
- Domain elektron ikatan atau disebut juga pasangan elektron ikatan (PEI) = 3. Terjadi antara atom pusat N yang berikatan 3 buah atom H.
- Domain elektron bebas atau disebut juga pasangan elektron bebas (PEB) = 1, merupakan pasangan elektron bebas milik atom pusat N.
- Antara sepasang elektron bebas atom pusat N dengan tiga pasang elektron ikatan atom H terjadi interaksi tolak-menolak.
Tipe molekul adalah ![]()
- A = atom pusat ⇒ N
- X = pasangan elektron ikatan (PEI)
- m = jumlah PEI ⇒ 3 (atau terikat dengan 3 atom H)
- E = pasangan elektron bebas (PEB)
- n = jumlah PEB ⇒ 1
Dengan demikian tipe molekulnya adalah ![]()
Bentuk molekulnya adalah trigonal piramida atau boleh disebut juga segitiga piramida.
10. (Chapter 11)
Jawaban : D
Dengan menyimak tabel berikut maka dengan jelas dapat ditentukan. Jawaban yang tepat D. Ion-dipol.
| Zat | ΔHvap (kJ/mol) |
|---|---|
| Argon (Ar) | 6,3 |
| Benzena (C6H6) | 31,0 |
| Etanol (C2H5OH) | 39,3 |
| Air (H2O) | 40,8 |
| Metana (CH4) | 9,2 |
Menguap sama artinya mengubah partikel cair menjadi gas. Untuk menjadi gas dari cairan maka partikel-partikel yang berinteraksi harus memisahkan diri. Energi penguapan (∆Hvaporation) menunjukkan besar energi yang diperlukan untuk memutuskan interaksi antarpartikel. Semakin kuat interaksi atau gaya tarik-menarik antarpartikel maka dibutuhkan energi penguapan lebih besar. Jadi gaya interaksi terkuat pada soal ini adalah Air dengan ∆Hvaporation terbesar.
11. (Chapter 12)
Jawaban : E
Pembahasan
Sifat koligatif larutan adalah sifat-sifat yang hanya tergantung pada Jumlah (kuantitas) partikel zat terlarut dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat terlarut, tidak peduli dalam bentuk otom, ion, ataupun molekul. Sifat koligatif merupakan sifat yang hanya memandang “kuantitas” bukan “kualitas”.
A. Tekanan uap jenuh lebih tinggi daripada tekanan uap jenuh pelarut
B. Titik beku larutan lebih tinggi darpada titik beku pelarut
C. Tekanan osmosis larutan lebih rendah dari tekanan osmotik pelarut
D. Titik didih larutan lebih tinggi daripada titik didih pelarut
E. Titik didih pelarut lebih tinggi dari pelarutnya
Jawaban : D
Pembahasan
Keberadaan zat terlarut dalam pelarut dapat mengakibatkan terjadinya kenaikan titik didih larutan,karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut tersebut. Sehingga dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan sehingga sama dengan tekanan eksternal.

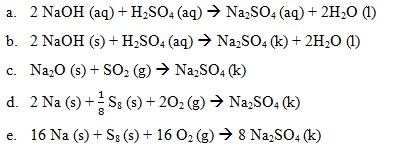



Tidak ada komentar:
Posting Komentar